
 日期:2024/5/21
日期:2024/5/21 来源:
来源:
小RNA(small non-coding RNA, sRNA)分子,包括siRNA,miRNA,piRNA,tsRNA等长度分布在15-50nt的小RNA片段,目前已发现在器官发育、肿瘤发生以及表观遗传调控等多种生物学过程中发挥重要功能。近年来针对小RNA分子片段的研究深刻揭示了小RNA的类型多样性与功能复杂性,也促进了精确定量、低偏好性的小RNA检测方法的开发以及在各种组织细胞中的应用。
基于二代测序(next-generation sequencing, NGS)的方法以其高通量、低成本、可精确读取sRNA序列全长等优势,被广泛用于小RNA表达的组学研究。然而,基于已经明确的复杂 RNA 表观修饰(包括内部及两侧末端修饰,如 piRNA 末端 2’-O Methyl)、稳定二级结构形成(如 tRNA 片段),以及与 adapter 类似的长度分布,这些因素导致目前 NGS 检测小RNA分子存在巨大的偏好性,可能造成实验结果的误读误判。为此科学家从不同角度出发,对经典的小RNA建库测序方法进行改进,进而降低小RNA捕获的偏好并尽可能多的兼容RNA修饰。
2024年5月7日,合肥综合性国家科学中心大健康研究院前沿交叉科学与生物医学研究所鲍坚强课题组在WIREs RNA 期刊发表题为 “Untacking small RNA profiling and RNA fragment footprinting: Approaches and challenges in library construction”的受邀综述,系统总结了现阶段各种基于NGS的小RNA建库测序方法,分析比较了其在降低偏好与兼容RNA修饰方面做出的改进。这些技术的改进,对于延伸到功能 RNA组学(RNAome)中研究RNA-protein互作所需要建立的小RNA片断测序方法具有重要的启示。

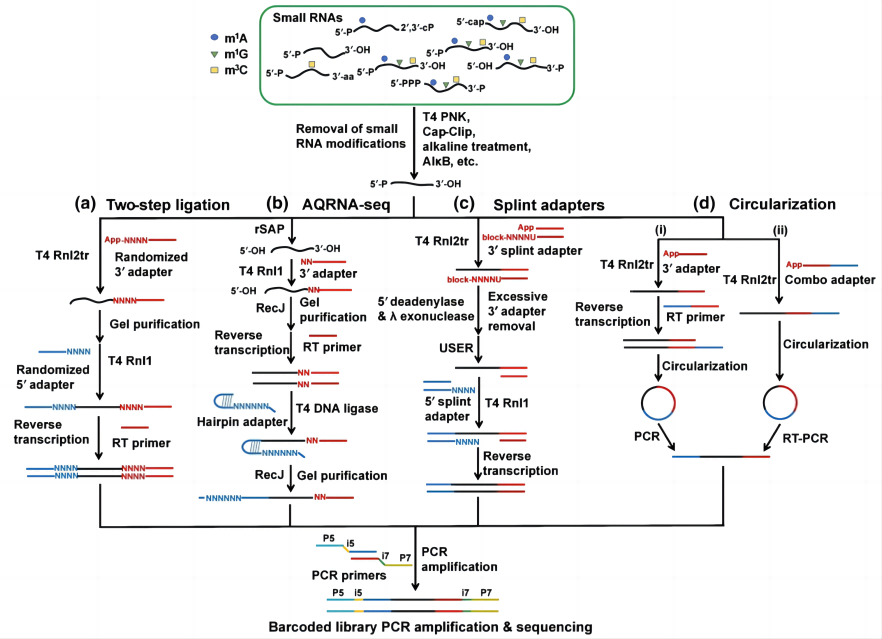
1. 基于RNA连接的小RNA建库方法:
小RNA缺乏一致的特征性序列,因此经典的小RNA建库通过RNA连接酶将接头序列直接连接在小RNA的5’与3’端,再通过RT-PCR获得可供测序的cDNA文库。完整的RNA连接酶可介导任意DNA/RNA的5’-P与RNA的3’-OH之间发生连接,因此许多方法采用5’-rApp修饰的3’接头以及截短并突变的T4 RNA连接酶II(T4 Rnl2tr, KQ),使其在不添加ATP的条件下完成3’-接头连接以降低小RNA相互连接形成聚集嵌合体的概率。除此之外,还有方法通过碱性磷酸酶将RNA的5’-P催化为5’-OH,以防止3’接头连接时小RNA的相互连接。由于5’-OH限制了5’接头的连接,该方法将第二个接头连接与cDNA的3’端,并将接头设计为末端随机化的茎环以提高连接效率。
由于小RNA序列的随机性,其会与接头发生部分碱基的互补配对以形成不同的茎环二级结构,而RNA连接酶对不同的二级结构具有显著的偏好性,因此许多方法通过将接头末端的序列进行随机化来降低接头连接的偏好。也有方法采用双链接头,并将随机序列添加在非连接的“夹板”链上,以确保RNA与接头之间形成有利于连接的二级结构。3’接头的“夹板”经过处理后,可直接作为引物启动cDNA的合成。
与以上需要两次接头连接的方法不同,部分研究仅在小RNA的3’端连接接头,之后对RNA或cDNA进行环化,通过酶切或PCR反应获得两端带有接头的cDNA文库。此类方法避免了5’接头连接,但由于RNA与单链DNA环化效率的局限性,因此较少用于小RNA的建库测序。
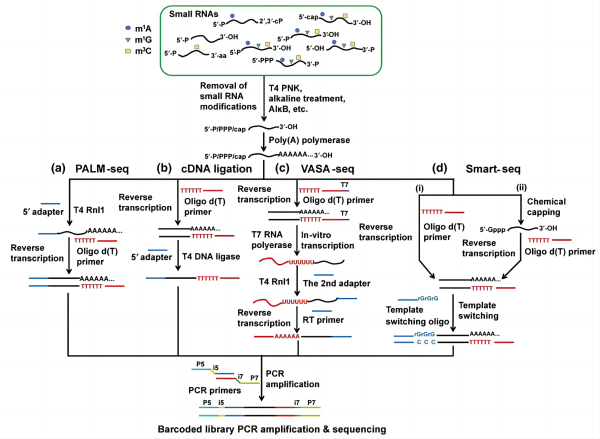
2. 基于poly(A)加尾的小RNA建库方法:
对于mRNA的建库与测序,绝大多数方法倾向于通过Oligo dT引物与mRNA 3’端的poly(A)序列互补配对实现对mRNA的捕获。Poly(A)聚合酶(poly(A) polymerase, PAP)可在ATP的辅助下,向RNA的3’-OH添加腺苷酸,故可用于向无3’-修饰的小RNA添加poly(A)尾。加尾的小RNA可通过Oligo dT捕获,再通过RNA连接、cDNA连接、模板转换(template switching)等方式添加另一个接头。值得注意的是,由于大多数小RNA缺乏5’-cap结构,其模板转换效率显著弱于mRNA,除非在建库前通过化学手段为小RNA添加5’-Gppp帽。由于PAP不能兼容包括2’-O-甲基化(2’-O-methylation)在内的多种RNA的3’修饰,因此基于poly(A)加尾法捕获的小RNA种类存在一定的偏好。
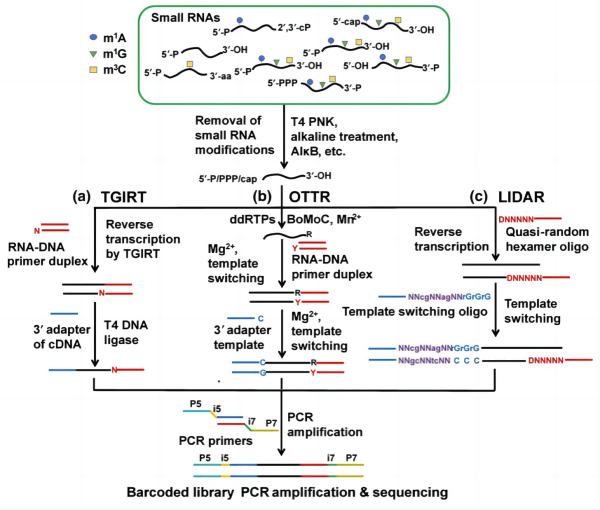
3. 其他小RNA建库测序方法:
与逆转录病毒来源的逆转录酶相比,II类内含子(group II intron)编码的逆转录酶具有更高的修饰兼容性,且仅需1个碱基的互补配对即可实现模板转换。基于以上特性,部分小RNA建库方法通过II类内含子逆转录酶介导的模板转换实现3’接头的添加与逆转录的起始,而5’接头则通过cDNA连接或第二次模板转换添加到cDNA上。此类方法受到小RNA末端序列以及修饰的影响较大,且目前商业化的II类内含子逆转录酶种类有限,因此未广泛用于小RNA的建库测序。
随机引物介导的逆转录是长非编码RNA(long non-coding RNA)建库测序的常用方法,但受到建库副产物的影响其在小RNA测序领域的应用受限。近年来的一项研究通过对引物序列的改进,大大减少了建库副产物的生成,使其可用于小RNA的建库测序。尽管基于随机引物的方法理论上可规避所有影响3’接头添加的RNA修饰,其3’序列捕获率低的缺陷不利于小RNA的注释以及序列全长的读取。
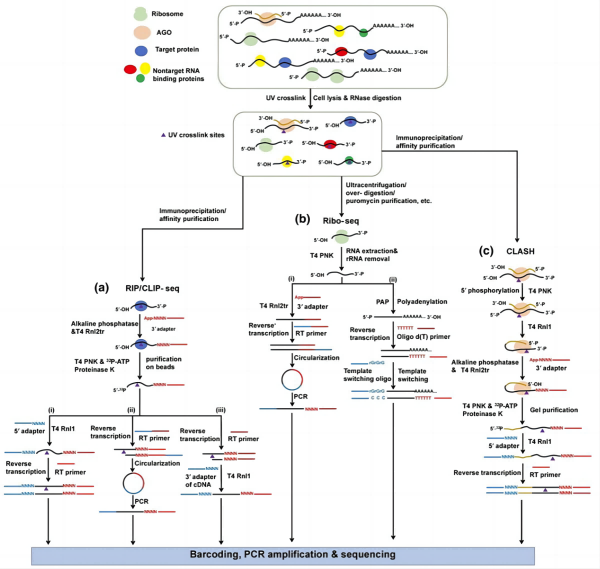
4. 小RNA建库测序方法对功能基因组学 Protein-RNA互作研究的启发:
现阶段研究RNA-蛋白质互作的方法主要包括RNA免疫沉淀(RNA immunoprecipitation, RIP),交联免疫沉淀(cross-linking immunoprecipitation, CLIP-seq)以及翻译组测序(Ribo-seq),其主要通过特异性抗体、融合标签以及分子量、热稳定性等理化性质,将目标蛋白及其结合的小RNA片断富集筛选出来,以确定与目标蛋白直接结合的RNA序列。
由于小RNA建库方法本质上是对一段较短的RNA序列的捕获,因此小RNA建库常用接头添加手段(包括RNA/cDNA的连接与环化、poly(A)加尾与模板转换等)经过略微修改后可直接用于Protein-RNA互作片段的建库。值得注意的是,对于CLIP-seq而言,由于紫外照射介导的RNA-蛋白质共价结合位点对逆转录的延申具有强烈的抑制作用,故基于环化或cDNA连接的5’接头连接方法更有助于RNA片段的捕获与交联位点的定位。
综上所述,尽管不同的小RNA建库方法从不同角度对经典方法进行了改进与完善,现阶段仍然缺乏一个低起始量、高灵敏度,无偏好性的小RNA建库、测序方法。如何吸收、改善已有小RNA建库方法的优缺点,并将其用于设计新的小RNA建库方法以及RNA-蛋白互作检测方法,是目前功能 RNAome 组学研究的重点与难点。
论文链接:https://wires.onlinelibrary.wiley.com/doi/full/10.1002/wrna.1852