
 日期:2024/6/17
日期:2024/6/17 来源:
来源:
2024年5月28日,合肥综合性国家科学中心大健康研究院先导医学与前沿技术研究所刘连新团队与郑州大学合作在Cell Discovery发表题为“IFRD1 promotes tumor cells “low-cost” survival under glutamine starvation via inhibiting histone H1.0 nucleophagy”的研究论文,本研究公开了干扰素相关发育调节因子1(IFRD1)在谷氨酰胺饥饿期间肝细胞癌(HCC)细胞适应性存活中的关键作用。IFRD1在谷氨酰胺饥饿下诱导,通过以 TRIM21 依赖性方式促进关键自噬调节因子 ATG14 的蛋白酶体降解来抑制自噬。
在谷氨酰胺剥夺状态下靶向IFRD1会增加自噬通量,引发癌细胞彻底死亡。这种效应主要是由于组蛋白H1.0的亲核降解,以及随之而来的与染色质可及性增强相关的核糖体和蛋白质生物合成的无节制增加。有趣的是,在临床前肝细胞癌模型中,IFRD1缺失与谷氨酰胺酶-1选择性抑制剂CB-839的治疗有协同作用,从而增强限制谷氨酰胺的效果。综上所述,研究结果揭示了IFRD1如何支持癌细胞在谷氨酰胺饥饿下的适应性生存,进一步强调了IFRD1作为抗癌应用中治疗靶点的潜力。

代谢重编程已被确定为癌细胞的基本标志之一。特别是,谷氨酰胺代谢为维持癌细胞的生长提供了重要的碳和氮来源。对谷氨酰胺的高度依赖,通常称为谷氨酰胺成瘾,为谷氨酰胺饥饿疗法奠定了基础。针对这一概念,已经设想了不同的方法,一种方法是通过抑制膜谷氨酰胺转运蛋白(如SLC1A5)来靶向谷氨酰胺摄取,SLC1A5在多种肿瘤中上调。尽管如此,这些策略目前收效甚微。缺乏疗效似乎与从头谷氨酰胺合成途径的激活有关。值得注意的是,这与肿瘤产生耐药性有关。不同的GLS抑制剂,也显示出有希望的临床前抗肿瘤活性,但不幸的是,在早期临床试验显示出显着的胃肠道毒性和神经毒性后,这些药物被停用。此外,还开发了一种GLS1选择性抑制剂(CB-839),虽然作为单一疗法无效,但与CB-839的联合治疗为肾癌和结直肠癌患者带来了生存益处。GLS抑制剂或谷氨酰胺耗竭对肝细胞癌(HCC)的适用性仍处于临床前阶段,研究表明,肝癌细胞表现出与自身产生的适应性机制相关的敏感性改变。在谷氨酰胺转运抑制方面,GPNA被描述为第一代拮抗剂,但后来由于效力低而被取代。鉴于没有一种谷氨酰胺靶向方法具有预期的临床影响,因此应该更深入地了解使癌细胞能够克服谷氨酰胺饥饿的分子机制。研究小组一直致力于确定谷氨酰胺剥夺疗法中治疗耐药性的根本原因,并就此发表了一系列文章。然而,有一个挥之不去的问题。尽管人们普遍认为细胞会响应谷氨酰胺剥夺而启动自噬,以应对氮和碳源的短缺,但实际上,尽管谷氨酰胺剥夺时间延长,肿瘤细胞不会经历广泛的自噬。这表明肿瘤细胞可能具有内在机制来防止自噬的不受控制的激活,并在谷氨酰胺剥夺下维持存活。
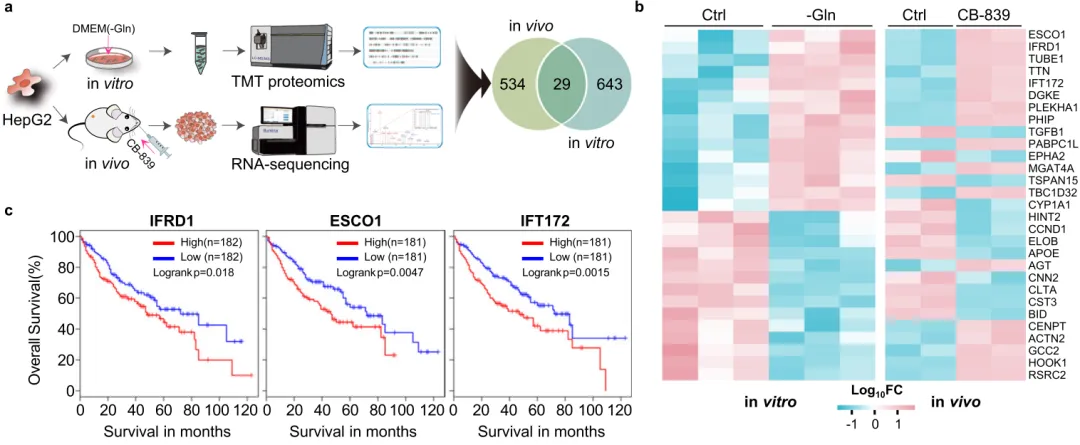
在这项研究中,试图确定促进 HCC 细胞适应谷氨酰胺剥夺的基本调节因子。为了实现这一目标,采用转录组学和蛋白质组学的组合测序数据来鉴定HCC细胞中诱导的基因和蛋白质,以响应限制性谷氨酰胺条件。这种方法发现了一种新的应激反应介质,即干扰素相关发育调节因子1(IFRD1),它以前与病理生理过程中的转录调控有关,尽管它在癌症发展和进展中的作用研究不足。研究发现将HCC细胞暴露于限制性外源性谷氨酰胺会导致 MAFG 介导的IFRD1转录上调。研究观察到IFRD1主要位于内质网(ER),通过促进ATG14的泛素化和降解来抑制自噬通量,ATG14是自噬起始的关键调节因子。这种效果是通过IFRD1促进ATG14和E3泛素连接酶TRIM21之间的相互作用来实现的。出乎意料的是,研究发现组蛋白H1.0(一种核蛋白)经历了由IFRD1介导的核噬降解。作为推论,在谷氨酰胺饥饿下与 IFRD1 缺失相关的自噬增加促进了组蛋白 H1.0 降解,从而增强了染色质的可及性和核糖体生物合成相关基因的表达。面对有限的外源性谷氨酰胺来源,由此产生的过度活跃的蛋白质合成促进了自噬介导的 HCC 细胞死亡。值得注意的是,临床前模型证实,谷氨酰胺剥夺/CB-839 联合治疗与 IFRD1 缺失会导致体内肿瘤消退。总的来说,研究数据将IFRD1确定为在HCC和其他癌症中利用谷氨酰胺饥饿策略的潜在主要靶点。
论文链接:https://doi.org/10.1038/s41421-024-00668-x