
 日期:2023/9/16
日期:2023/9/16 来源:
来源:
肿瘤血管构成了纳米药物进入肿瘤组织的主要途径,因此纳米药物的高效递送在很大程度上依赖于血管系统。目前的研究范式主要基于1986年首次提出的“增强渗透和滞留效应”(EPR, Enhanced Permeability and Retention effect)理论。该理论认为,肿瘤血管内皮细胞屏障是纳米药物渗透到肿瘤组织的最后一道防线,纳米药物可以利用肿瘤血管的高渗透性来跨越这一屏障,从而直接进入肿瘤微环境。
然而,临床前和临床研究的结果均显示,纳米药物对肿瘤的递送效率仍然不尽如人意。某些研究数据甚至表明,纳米载体仅能将大约0.7%的药物有效递送至肿瘤组织。这一发现不禁引发了疑问:是否存在其他尚未被充分认识的机制,这些机制可能在非内皮细胞屏障层面阻碍了纳米药物的血管外渗透?
近期,合肥综合性国家科学中心大健康研究院资深研究员王育才及中国科学技术大学副教授蒋为的研究团队在《Nature Nanotechnology》杂志在线发表了一篇题为“Breaking through the Basement Membrane Barrier to Improve Nanotherapeutic Delivery to Tumours”的研究论文。利用自主研发的多层次活体显微成像技术,研究团队首次明确指出,肿瘤血管外侧存在一层致密的基底膜结构,该结构严重阻碍了纳米药物的血管外渗透能力,导致纳米药物在肿瘤血管外形成“血池”样的积累。

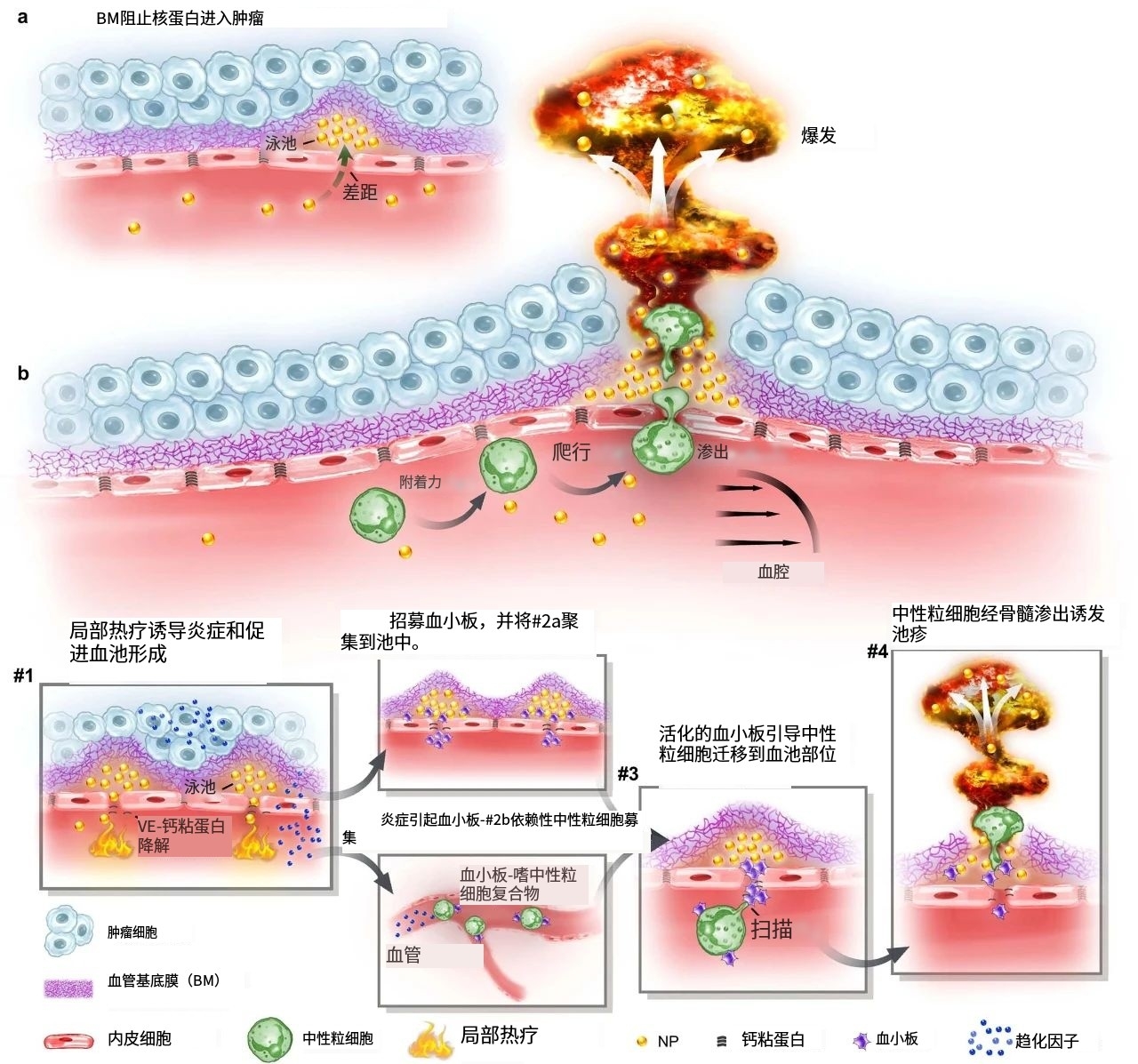
该研究通过深入的活体显微成像分析,解析了这种由基底膜构成的“血池”的空间定位、微观结构以及成因,并进一步揭示了酶降解基底膜能显著减少“血池”的数量,从而增强纳米药物的渗透效率。研究还进一步证实,通过炎症诱导的中性粒细胞迁出机制,能在基底膜上短暂形成一个动态“窗口”,从而实现纳米药物火山喷发式的高效渗透,有效提升了纳米药物在肿瘤组织中的富集和治疗效果。
该研究不仅提出了一种与传统EPR效应截然不同的纳米药物富集创新机理,还为纳米药物在肿瘤治疗方面的应用提供了新的理论支持,并刷新了我们对纳米药物跨血管转运机制的整体认识,为该领域的理论和应用研究提供了重要的突破。
纳米药物积累在肿瘤血管外形成“血池”样的结构
为了动态解析纳米药物与肿瘤血管生物界面的相互作用,研究者首先构建了高时空分辨活体显微肿瘤血管的成像平台。利用该成像平台,研究者惊奇地发现纳米颗粒到达肿瘤后,会聚集在肿瘤血管周围的区域,形成纳米颗粒“血池”(图1)。进一步研究发现,在多种肿瘤模型中均发现这种血池结构,并且这种血池的形成具有纳米尺寸依赖性。通过对血池三维成像以及空间定位分析显示,血池位于血管内皮细胞的外侧空间,这说明血池中积累的纳米颗粒已经跨过内皮细胞屏障。通过延时成像观察到血池中纳米颗粒无法进一步渗漏到肿瘤组织中。这些结果表明,纳米颗粒即使通过跨过内皮细胞屏障,也无法直接渗透到肿瘤组织中,可能存在一个非内皮细胞屏障阻止纳米颗粒进一步渗漏,这将严重限制纳米药物进入肿瘤组织发挥作用!
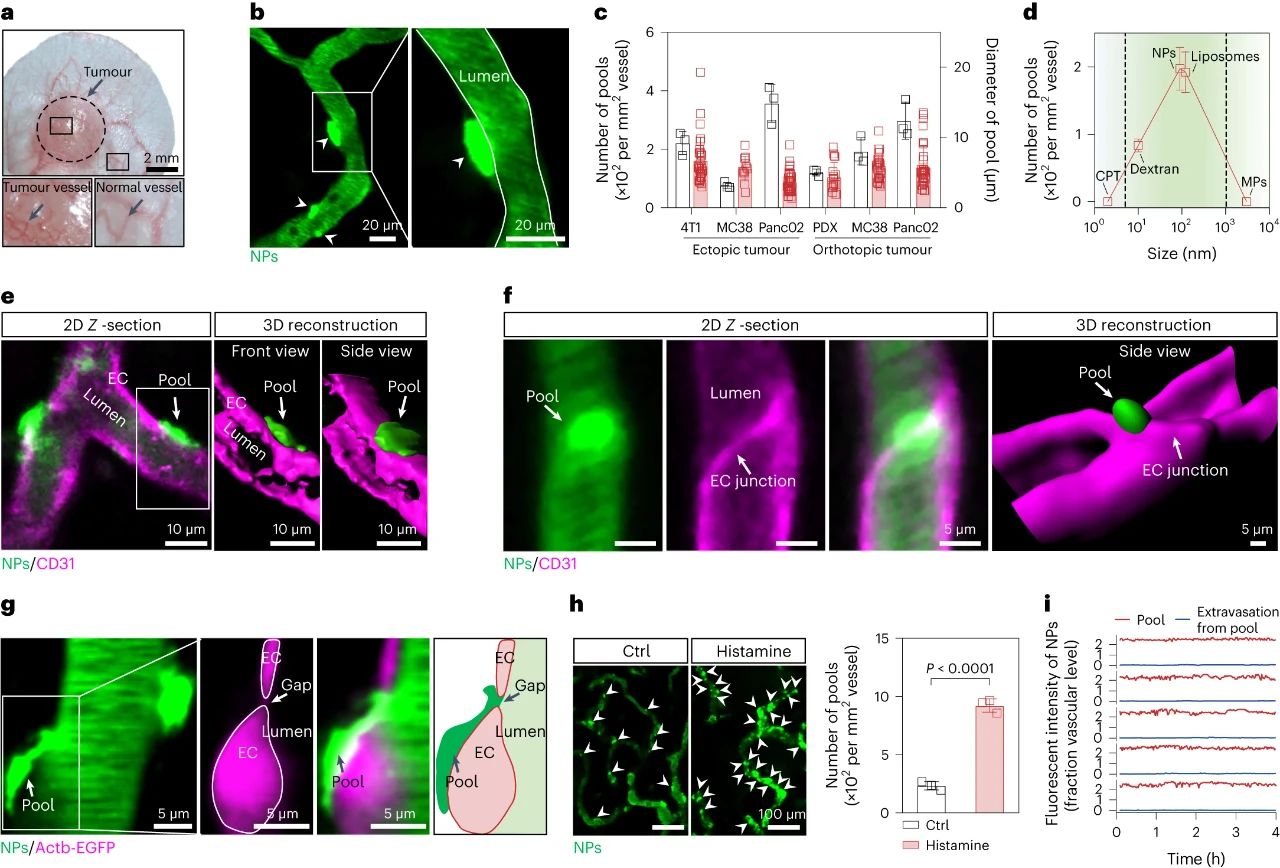
图1. 纳米颗粒在肿瘤血管外形成血池
基底膜阻止纳米颗粒外渗是血池形成的原因
研究者通过探讨血管结构,来解释血池形成的原因。基底膜是上皮和内皮组织下一层致密的、高度交联的片状细胞外基质,主要由IV型胶原构成。研究者利用免疫组化、三维荧光成像、组织电镜等技术,发现肿瘤血管内皮细胞外侧包被一层致密的基底膜,其覆盖率高达95%。进一步研究者通过活体显微成像,发现基底膜可以阻止纳米颗粒的渗透,使其滞留在内皮细胞下空间从而形成纳米颗粒“血池”,进一步发现通过胶原酶降解基底膜显著减少了血池的形成,并有效增强了纳米颗粒的肿瘤渗透。以上结果表明,基底膜是阻止纳米颗粒进入肿瘤组织的、被长期忽略的屏障,破坏基底膜屏障可以增加纳米颗粒进入肿瘤基质(图2)。
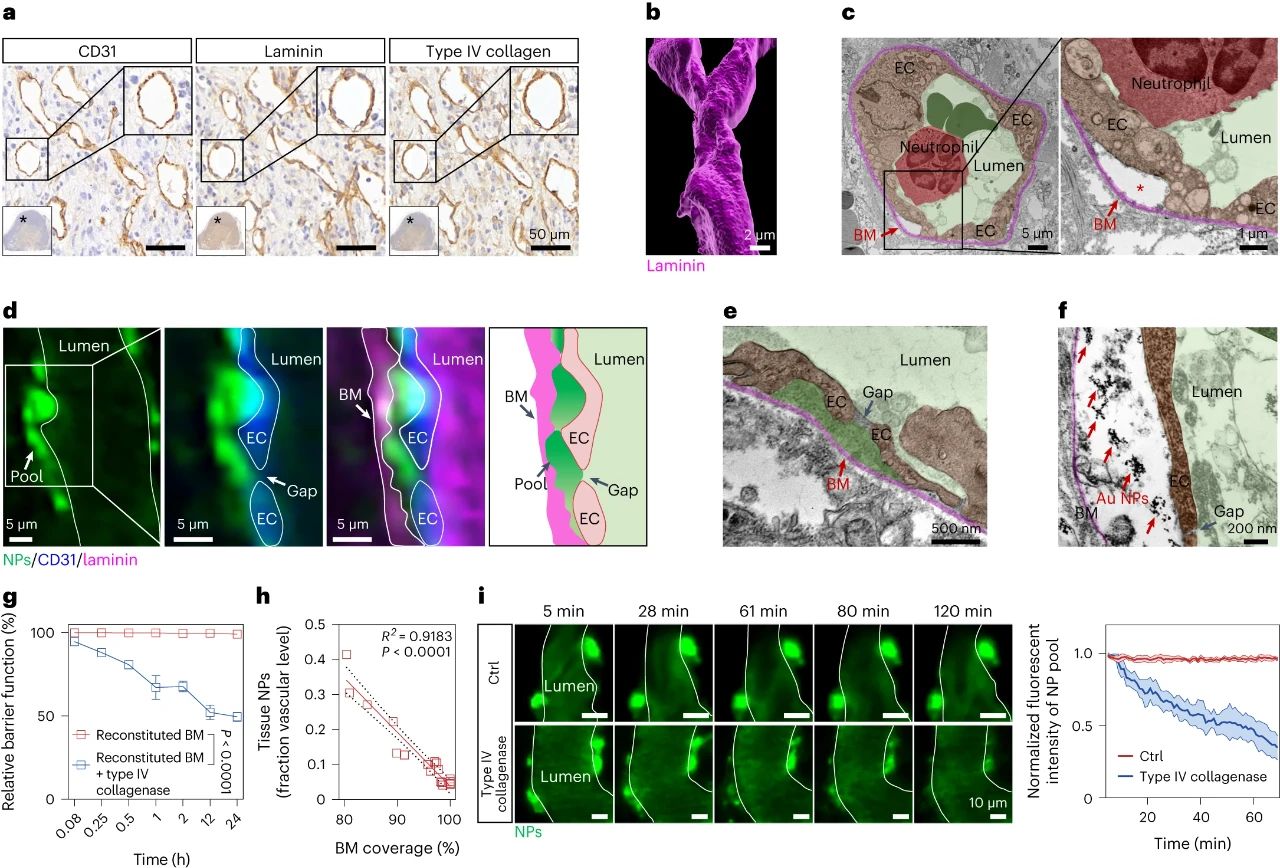
图2. 基底膜是阻止纳米颗粒进入肿瘤的屏障
诱导炎症通过破坏内皮粘附连接促进血池形成
虽然胶原酶可以打开肿瘤基底膜屏障有效增加了纳米颗粒的外渗,但酶解作用可能导致基底膜不可逆转的破坏,增加肿瘤转移的风险,因此研究者想要发展一种可短暂打开基底膜屏障的安全策略。
当组织发生无菌性炎症,免疫细胞被招募至炎症部位的过程中,会短暂打开基底膜屏障。受此启发,研究者首先利用局部热疗(LHT)在肿瘤诱导急性无菌性炎症,发现肿瘤血管上出现大量血池(图3)。随后通过组织电镜、免疫组化等手段发现,急性炎症处理使得内皮细胞上的VE-钙连蛋白经磷酸化后降解,继而诱导肌动蛋白-肌球蛋白纤维收缩,导致内皮细胞间隙的开放。上述结果证明,在无菌性炎症处理后,血管内皮细胞间隙被打开,纳米颗粒通过内皮细胞间隙进入内皮下空间,从而形成更多血池。
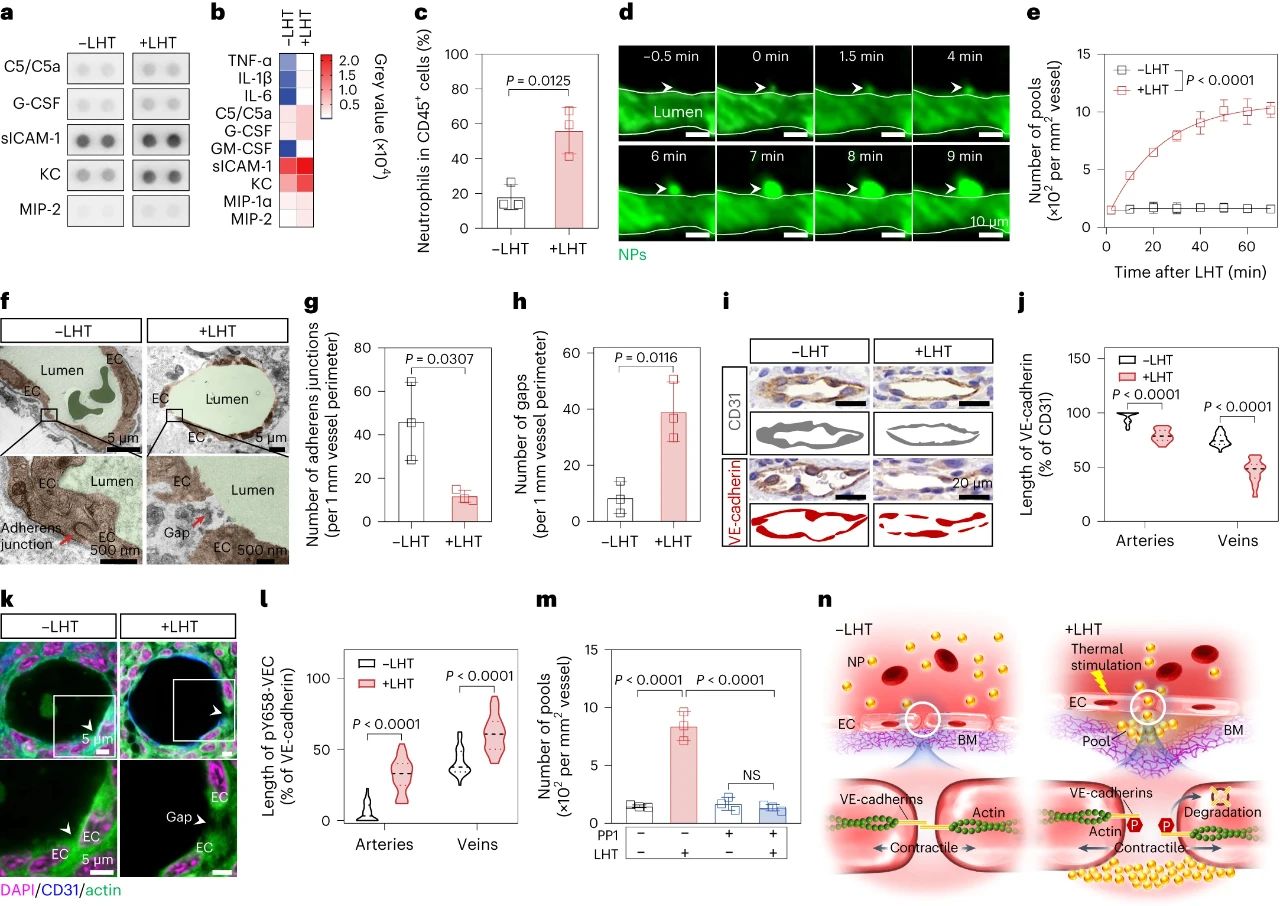
图3. 局部热疗通过打开粘附连接间隙促进更多纳米颗粒血池的形成
局部炎症诱导血池中的纳米颗粒通过喷发渗漏到肿瘤组织基质
研究者探究了急性炎症处理后能否打开基底膜屏障,实现血池中纳米颗粒的血管外渗透。活体显微成像观察到,急性炎症处理后,血池部位出现了剧烈的纳米颗粒动态外渗,覆盖了巨大的肿瘤间质区域,渗透深度约为65微米(定义为血池喷发)(图4)。这说明急性炎症处理可以克服基底膜屏障诱导血池喷发,并将血池中的纳米颗粒释放到肿瘤基质中。这种喷发效应发生在急性炎症处理后30分钟,并且在整个观察过程持续出现。有趣的是,诱导急性炎症处理可以在同一处血池产生多次喷发。以一个血池喷发的典型事例来看,该血池在一小时内产生了三次强度不同的连续喷发。单个血池的喷发过程大多集中在2-10分钟,喷发次数在1-4次不等。因此,在急性炎症处理下,血池的喷发效应可以实现纳米颗粒在肿瘤基质中更深、更强的渗透与富集。
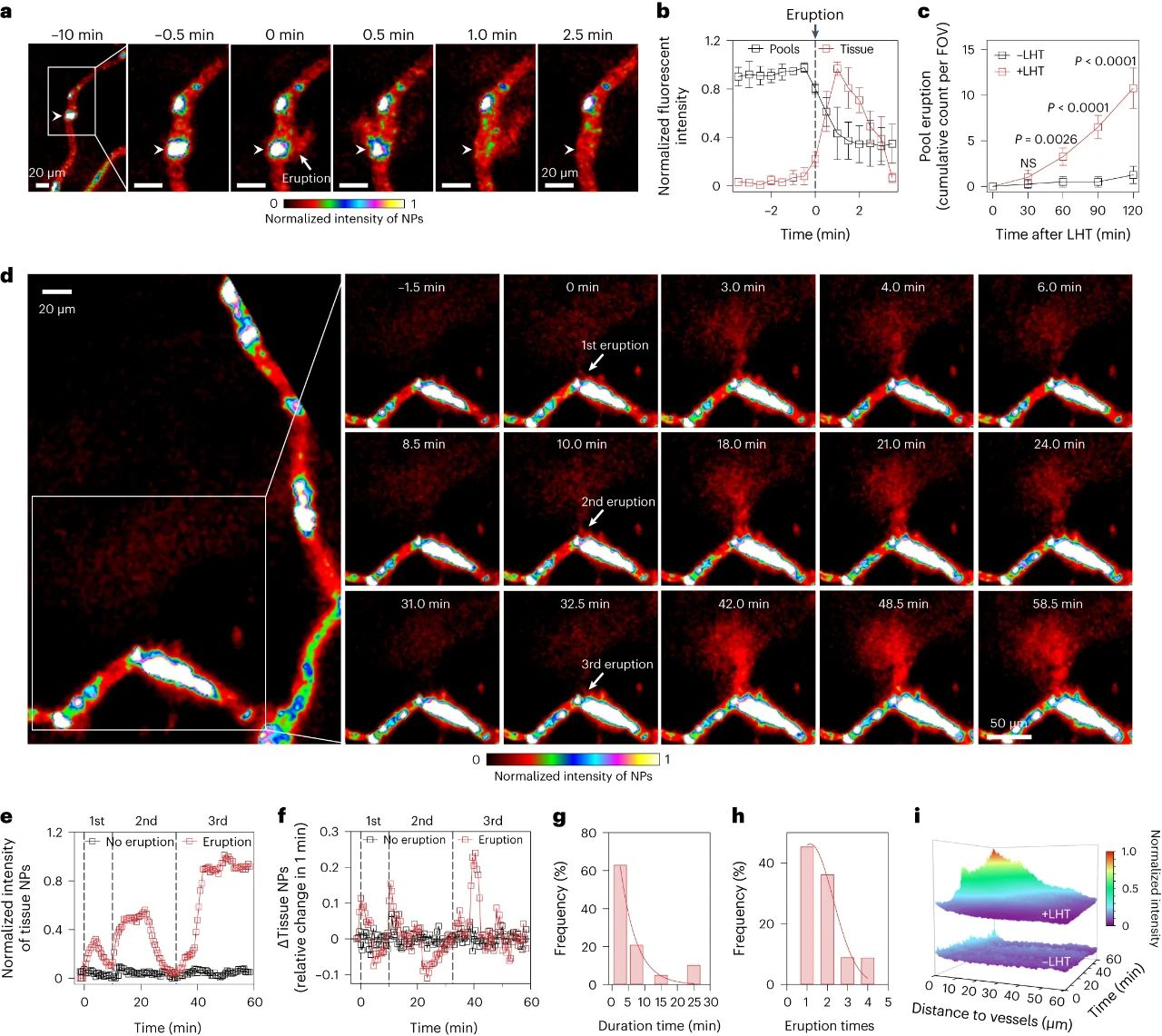
图4.急性炎症诱导的血池喷发将“困住”的纳米颗粒释放到肿瘤间质中
中性粒细胞突破基底膜屏障介导血池喷发
通过活体显微成像,研究者发现在急性炎症反应过程中,中性粒细胞能够快速响应,通过趋化反应跨血管向肿瘤组织迁移。研究者还观察到中性粒细胞完整的血管渗出的级联过程,包括滚动、粘附、爬行和迁移等(图5)。值得注意的是,在中性粒细胞跨过血池的瞬间,血池发生了喷发。然而,当中性粒细胞被清除后,研究者发现炎症诱导血池喷发的频率明显下降,这证明了中性粒细胞的血管外渗是血池喷发的原因。在血池喷发过程中,血池出现了2-6微米的动态窗孔,该过程持续了2-6分钟。一旦中性粒细胞完成血管跨越,这些窗孔随即消失,这进一步说明了中性粒细胞的外渗过程的确打开了血池的基底膜屏障,并诱导了血池的喷发。通过阻断中粒细胞识别基底膜的功能后,虽然中性粒细胞仍能够迁移至血池部位,但无法诱导血池喷发。这些结果表明,血池喷发是通过中性粒细胞外渗短暂打开基底膜屏障这一过程实现的。
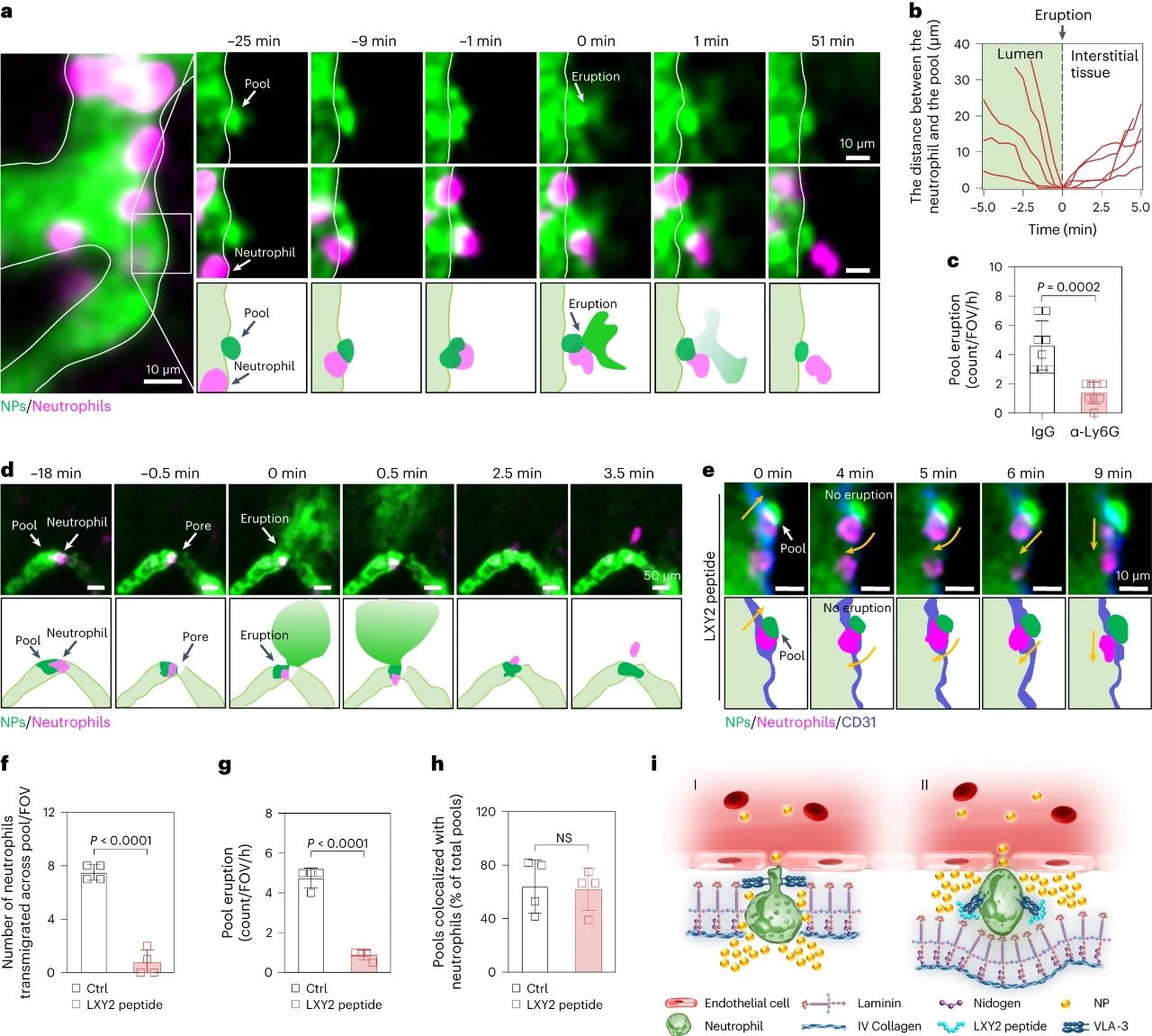
图5. 中性粒细胞打开基底膜屏障介导血池喷发
激活的血小板招募中性粒细胞到达血池
最后,研究者对中性粒细胞迁移至血池的机制进行了深入的研究。研究者发现急性炎症处理后,大量血小板迅速招募至血池部位,扫描电子显微镜结果显示大量活化的血小板附着在损伤的内皮细胞间隙处(图6)。此外,研究者观察到急性炎症处理后约有64%中性粒细胞与活化血小板形成复合物,这种复合物将有助于中性粒细胞到达炎症部位。活体成像数据显示,一旦到达炎症部位,中粒细胞扫描并识别附着在血池处的血小板,从而精准定位至血池部位,随后打开基底膜屏障,诱导血池喷发。清除血小板后,招募的中性粒细胞数量明显减少,由于血小板在血池聚集不足,中性粒细胞无法定位至血池,最终导致血池喷发频率显著下降。综上所述,激活的血小板可以协助中性粒细胞精准到达血池部位并指导其跨越基底膜屏障。
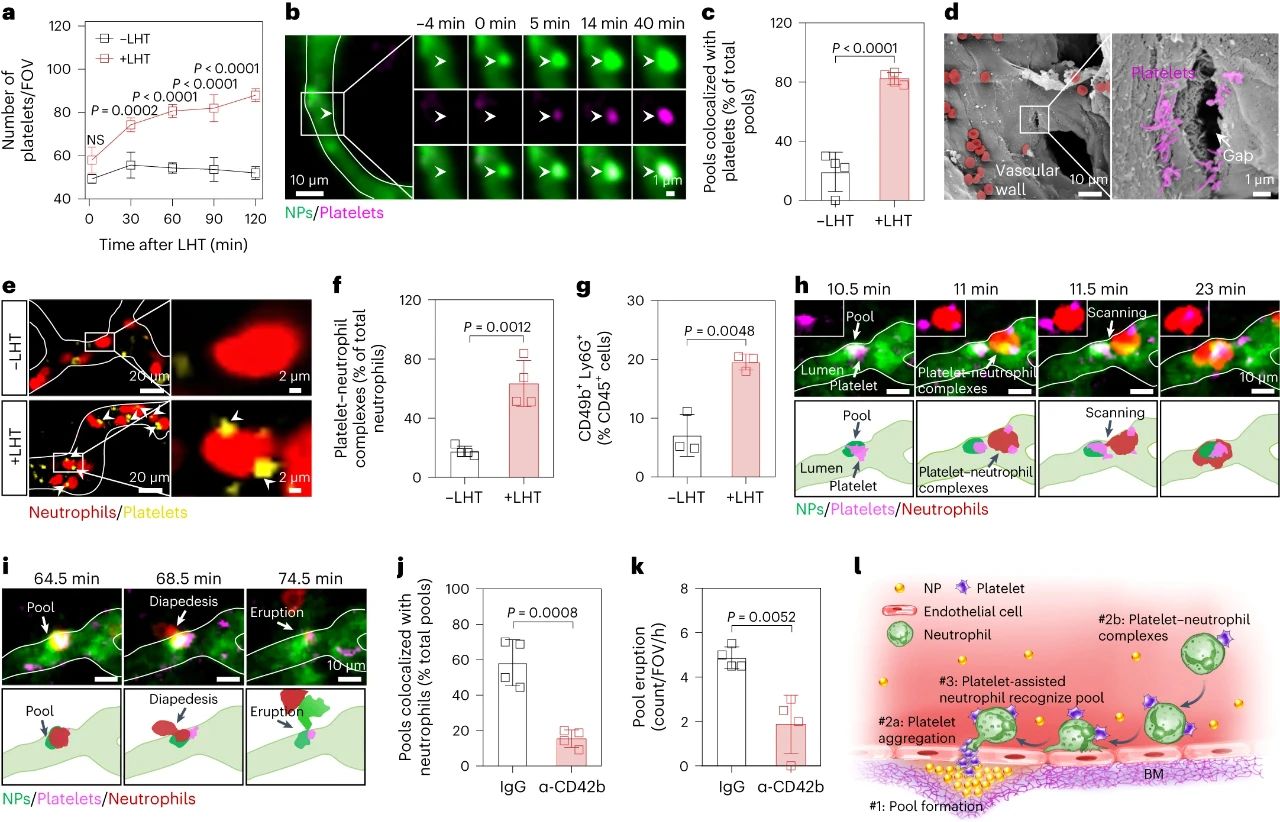
图6. 中性粒细胞依赖血小板招募到血池,进一步诱导血池喷发
基于上述结果,该工作率先提出基底膜是一道被长期忽视的,阻止纳米药物跨肿瘤血管渗透的新屏障,解析了由基底膜所构成的纳米药物“血池”样新结构;并揭示了诱导急性炎症可以增强纳米药物的肿瘤血管喷发效应。该工作挑战了经典的EPR效应,提出了纳米药物肿瘤递送新理论,回答了纳米药物的血管转运过程等基础科学问题,在纳米药物递送领域具有重要意义,为设计高效肿瘤递送的新型纳米药物提供理论支撑。
中国科学技术大学博士后汪沁、博士生梁启蕊为该论文共同第一作者,合肥综合性国家科学中心大健康研究院资深研究员王育才、中国科学技术大学蒋为副教授与新加坡国立大学David Tai Leong教授为本文共同通讯作者;团队其他成员及合作者也为本研究做出了重要贡献。
参考文献:Wang, Q., Liang, Q., Dou, J. et al. Breaking through the basement membrane barrier to improve nanotherapeutic delivery to tumours. Nat. Nanotechnol. (2023).
https://doi.org/10.1038/s41565-023-01498-w