
 日期:2023/6/19
日期:2023/6/19 来源:
来源:
机体免疫系统如何识别自我非我的抗原一直是免疫学的核心问题。机体已经发展了针对自我抗原的中枢耐受机制避免免疫系统攻击自身抗原(1960年诺贝尔生理与医学奖)。针对非我抗原,免疫系统已经发展出感知病原信号(PAMP)并启动免疫激活和清除机制的系统(2011年诺贝尔生理与医学奖),但是对于一些对人体无害的抗原比如肠道中来自共生微生物或食物的抗原,免疫系统会选择诱导外周耐受机制避免产生强烈的免疫反应危及自身。其中,食物抗原如何被识别并启动免疫耐受的机制一直不甚清晰。
GSDMD蛋白作为介导细胞焦亡(pyroptosis)的关键执行蛋白,近些年来受到了领域内学者们的广泛关注。其主要的功能是:当细胞受到病原相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)的刺激时,细胞内的信号感受器(NLR家族,AIM2蛋白以及CARD8, PYRIN等)会诱导形成炎症小体(inflammasome)并激活下游caspase-1/4/5/8/11对GSDMD的N端切割产生p30片段进而上细胞膜成孔引发细胞焦亡和炎性因子释放【1-5】。这些功能主要是在髓系细胞中进行探索时被发现,而在生理状态下,GSDMD在多种组织器官中都有着广泛表达,并且作为gasdermin家族的成员,GSDMD在肠道尤其小肠也有着极高的表达量,GSDMD的非焦亡功能以及在肠道发挥什么具体的生理作用也因此成为了亟待探索的科学问题。

2023年6月15日,合肥综合性国家科学中心大健康研究院朱书课题组在Cell发表题为Gasdermin D licenses MHCII induction to maintain food tolerance in the small intestine 的研究论文,发现了十二指肠中GSDMD可以被食物抗原诱导剪切N端产生p13片段,并入核调控肠道上皮细胞(IECs)的二类分子水平,诱导调节性的Tr1细胞介导食物耐受。
研究人员首先针对生理状态下各个组织细胞的GSDMD进行了蛋白印迹检测,发现检测的各组织样品中只有在小肠的IEC中能检测到一条大约13kD大小的剪切带,通过使用氨基酸水解食物(AAD amino acid diet)【6】,研究人员发现这一条剪切带来自GSDMD的N端并且是受到食物抗原诱导产生的。随后研究人员通过IP-MS技术并进行后续验证发现该片段是由食物抗原激活十二指肠IECs中的CASPASE-3/7切割GSDMD的88位天冬氨酸(人源GSDMD是87位)产生,并依此构建了GSDMD的小肠剪切突变GsdmdSICR鼠以进行后续研究(图一)。
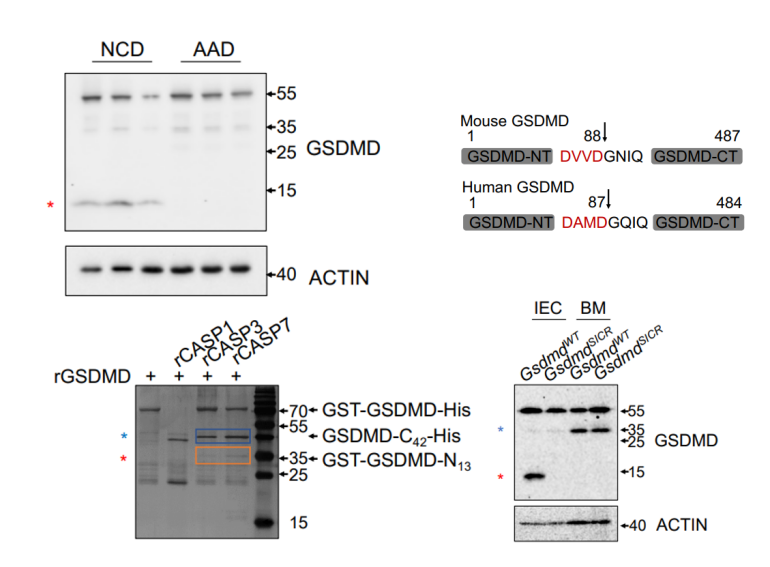
图一 CASP3/7在食物抗原诱导下切割GSDMD 88位天冬氨酸产生N13片段
那么,GSDMD的这一剪切在小肠中发挥着什么作用呢?研究人员首先构建了GSDMD的N13以及对应的C42片段的荧光质粒,发现N13片段会入核,并且发现辅助其入核的很有可能是核孔复合体的蛋白成员。通过比对GSDMD 野生鼠和敲除鼠的前端小肠IEC的RNA seq发现,GSDMD敲除会导致IEC的二类分子以及二类分子的转录因子Ciita的水平下降,随即针对多种基因编辑以及特殊处理小鼠前端小肠IEC的二类分子的FACS以及qPCR实验证实了这一点:即GSDMD的N13片段缺失会导致前端小肠IEC的二类分子表达水平显著降低。并且这一过程是通过N13片段影响STAT1对Ciita的转录调控,而缺失N13片段会使CIITA表达减少进而导致二类分子表达下降造成的。后续的单细胞RNA测序结果证实,生理状态下的这一变化只会发生的IEC中,对于其他经典的抗原递呈细胞(包括B细胞和髓系细胞)则没有影响。
并且,通过单细胞RNA测序结果,研究人员发现,前端小肠的Tr1细胞在N13片段缺失后明显减少,qPCR结果和FACS结果进一步佐证了N13片段缺失造成IEC二类分子下降会导致Tr1细胞减少。与之相呼应的是2020年Elinav课题组曾证实肠道IEC的二类分子表达水平会影响肠道CD4+IL-10+FoxP3-的T细胞水平【7】。而Tr1细胞作为一群免疫负调CD4+ T细胞,也被认为是诱导食物耐受的关键细胞之一【8】,再结合N13片段是由食物诱导产生且前端小肠具有营养物质的消化吸收的生理功能,研究人员猜测N13片段最终会参与诱导食物耐受。为此,研究人员针对多种基因表达背景小鼠构建了两组食物耐受模型,花生提取物诱导的花生过敏模型以及OVA诱导的迟发型超敏反应模型,发现无法产生N13片段的GsdmdSICR鼠、IEC MHCII在IEC特异敲除以及Tr1缺失的小鼠都呈现强烈的针对食物的过敏反应。
该工作详细阐述了GSDMD在前端小肠中会在食物诱导下形成一个N13剪切,该片段在核孔复合物帮助下入核并辅助增强了STAT1对Ciita的转录调节,使IEC的二类分子表达增加,从而诱导Tr1的上调,最终促进食物耐受形成,为维持宿主肠道稳态发挥了重要作用。
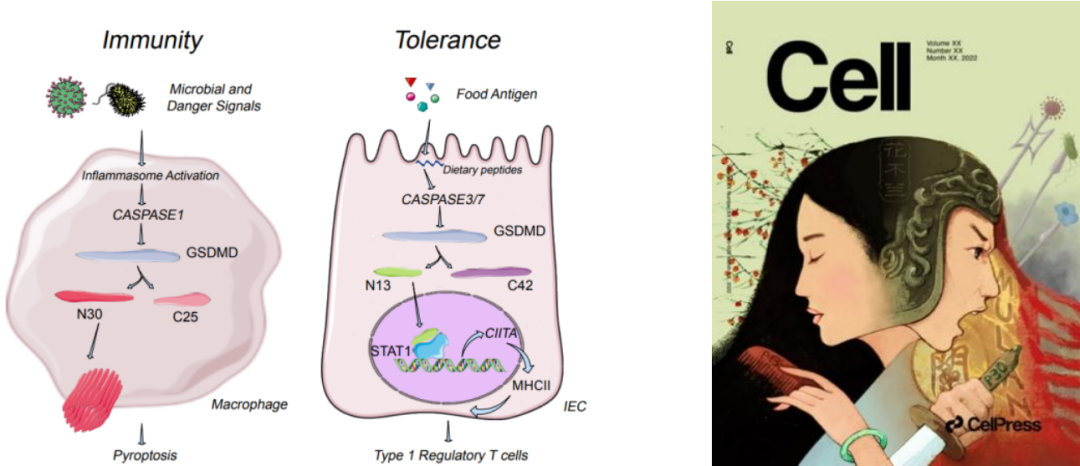
图四 GSDMD应对不同环境的双面功能
GSDMD分子在不同细胞中应对病原以及食物抗原,通过产生不同的剪切形式,行使上膜打孔或入核参与转录分别诱导免疫激活或免疫耐受,体现了同一个免疫分子的功能两面性。
文章来源丨BioArt
参考文献:
1. Shi, J., et al., Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature, 2015. 526(7575): p. 660-5.
2. Kayagaki, N., et al., Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling. Nature, 2015. 526(7575): p. 666-71.
3. Orning, P., et al., Pathogen blockade of TAK1 triggers caspase-8-dependent cleavage of gasdermin D and cell death. Science (New York, N.Y.), 2018. 362(6418): p. 1064-1069.
4. Wang, Q., et al., CARD8 is an inflammasome sensor for HIV-1 protease activity. Science, 2021. 371(6535).
5. Barnett, K.C., et al., A 360° view of the inflammasome: Mechanisms of activation, cell death, and diseases. Cell, 2023. 186(11): p. 2288-2312.
6. Kim, K.S., et al., Dietary antigens limit mucosal immunity by inducing regulatory T cells in the small intestine. Science, 2016. 351(6275): p. 858-63.
7. Tuganbaev, T., et al., Diet Diurnally Regulates Small Intestinal Microbiome-Epithelial-Immune Homeostasis and Enteritis. Cell, 2020. 182(6): p. 1441-1459 e21.
8. Battaglia, M., et al., IL-10-producing T regulatory type 1 cells and oral tolerance. Ann N Y Acad Sci, 2004. 1029: p. 142-53.