
 日期:2021/10/22
日期:2021/10/22 来源:
来源:
近日,来自合肥综合性国家科学中心大健康研究院副院长朱书课题组和哈佛大学医学院吴皓课题组科研人员发现了NLRP6炎症小体组装过程中的“秘密”——液液相分离,打开了“相分离”在炎症小体研究的大门。相关研究成果在线发表于Cell。

模式识别受体(Pattern recognition receptors,PRRs)对病原微生物的快速识别是机体先天免疫系统的重要一环,可以有效抵御病毒入侵。模式识别受体家族中的NLRP6已经被证明可以参与炎症小体(Inflammasome)的形成,从而影响肠道的稳态和微生物定植。一个经典的炎症小体通常由传感器分子和衔接蛋白ASC以及Caspase前体组成,它的激活可以促进炎性细胞因子的活化,或者介导细胞焦亡,在应对病原体侵入中发挥了重要功能。遗憾的是,对于炎症小体组装的调节仍所知甚少。最近,NLRP6炎症小体组装的神秘面纱终于被解开!
以NLRP6识别的配体为突破
炎症小体的激活依赖传感器分子对配体的识别,目前报道了许多NLRP6的潜在配体,例如双链RNA、革兰氏阳性菌细胞壁表面成分——脂磷壁酸(LTA)以及代谢物等,虽然他们已经被证明可以激活NLRP6进而发挥免疫功能,但是它们是否与NLRP6直接结合,结合的亲和力是否有区别一直未得到实验的证明。
因此,研究人员将目光聚焦到了炎症小体激活的第一步——识别,首先在体外纯化了NLRP6蛋白,检测了与多种潜在配体的结合亲和力,发现与双链RNA的结合最强且随着RNA的长度增加亲和力也随之增加,此外LTA也可以和NLRP6结合,但亲和力稍弱,这也充分说明了NLRP6对病原体识别是有选择性的,成为了下一步研究的突破口。
组装的“秘密”——液液相分离
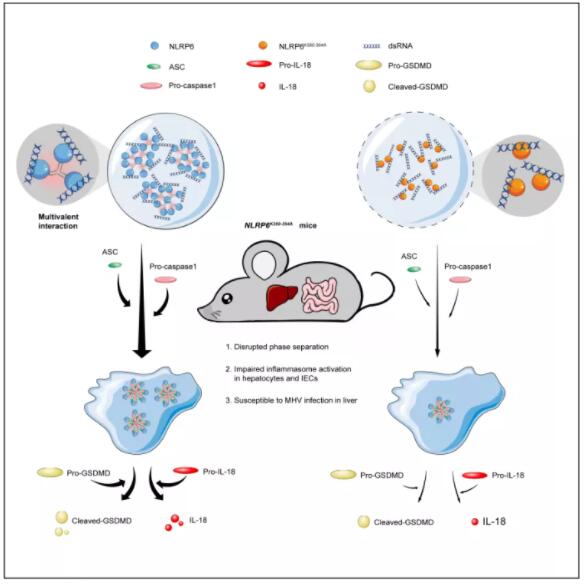
研究人员在对NLRP6与双链RNA结合的研究中发现两者可以形成液滴聚集体,随后通过一系列体外和细胞实验,研究人员揭开了这些聚集体神秘的面纱:双链RNA可以诱导NLRP6发生液液相分离,“相分离”这一概念早在2009年被提出,它的发现给困扰科学家多年的许多问题提供了全新的思路,细胞通过“相分离”来维持内部的秩序,一方面以特定的方式使特定的分子可以局部浓缩来提高反应效率;另一方面又可以排除其它不相关的分子的参与,使反应具有特异性。

图 dsRNA在体外和细胞内诱导NLRP6液液相分离
研究人员针对这一现象展开了一系列深入的研究,发现炎症小体的组装同样伴随着“相分离”的出现,在对液液相分离的发生机制研究中惊喜地发现了NLRP6重要的结构,即多个串联重复的赖氨酸。这种带正电荷的氨基酸的出现成为了“相分离”发生以及炎症小体激活的关键。不仅如此,为了在生理条件下证明“相分离”的重要性,研究人员通过CRISPR Cas9技术构建了赖氨酸突变鼠,分别构建了轮状病毒(Rotavirus,RV)感染肠道以及小鼠肝炎病毒(Mouse hepatitis virus,MHV)感染肝脏的两种病毒感染模型,首次在小鼠体内证明了“相分离”的功能。
创新:NLRP6反应器
除了双链RNA可以诱导NLRP6出现“相分离”,另一个与之结合的革兰氏阳性菌细胞壁表面成分——脂磷壁酸也有同样现象,在对其形成的液滴凝聚体分析之后,两个科研团队认为NLRP6的液液相分离很好的展示了NLRP6如何被激活,进而组装炎症小体的模型,“相分离”的发生使得以NLRP6为中心形成了一个微反应器,可以通过液液相分离整合多种信号,有条不紊地进行着对病原微生物的反击。这样一种模型的建立也许对模式识别受体家族的其它成员(例如NLRP3)提供了一些思路。
大健康研究院副院长朱书教授和哈佛大学医学院吴皓教授为论文共同通讯作者,吴皓教授课题组负责了本文体外现象和机制的研究,朱书教授课题组负责本文中细胞现象和机制,以及小鼠模型的研究。大健康研究院副院长朱书课题组的博士研究生Runzhi Li(李润智)和哈佛大学医学院吴皓课题组的Chen Shen(沈辰)为共同第一作者。本工作得到了大健康研究院院长田志刚教授,耶鲁大学Richard Flavell教授,生物物理所高璞研究员的帮助。此外,大健康研究院执行院长周荣斌教授、中国科大金腾川教授,北京大学胡家志教授、季雄教授、蒋争凡教授,中山大学郭德银教授也给本工作提供了诸多建议以及实验材料。
原文链接: