
 日期:2024/1/22
日期:2024/1/22 来源:
来源:
2023年12月4日,合肥综合性国家科学中心大健康研究院署名文章 Carnosine regulation of intracellular pH homeostasis promotes lysosome-dependent tumor immunoevasion 在 Nature Immunology 杂志发表,该研究发现当肿瘤细胞处于缺氧条件,Warburg效应增强(与正常细胞相比,即便在有氧条件下,肿瘤细胞也倾向于利用糖酵解的方式供能,这一现象被称为“Warburg 效应”,或有氧糖酵解),产生大量乳酸时,肿瘤细胞通过增强可移动缓冲物质肌肽的合成来抵抗胞内的过度酸化,从而维持胞内pH稳态,调节溶酶体在细胞内的定位和功能,并进一步参与调控免疫检查点蛋白Galectin-9的表达,最终促进肿瘤免疫逃逸和肝癌进展。

在本项研究中,张华凤课题组与高平课题组研究人员首先检测低氧条件下,肿瘤细胞内潜在的可移动缓冲物质含量的变化,并结合这些物质的生化特点(pKa)分析,发现肌肽是生理环境中最佳(pKa=6.76, 最接近生理pH)、变化最显著的可移动缓冲物, 并进一步证实了肌肽参与维持胞内pH稳态。具体的机制主要包括:1) 肌肽作为可移动缓冲物质能够与胞浆游离的H+结合,减缓胞内pH的波动; 2) 一部分肌肽通过在胞内pH相对较低的区域(如糖酵解发生的区域)和pH相对较高的区域(如细胞膜附近区域)之间切换其质子化状态,充当循环移动质子载体,从而为位于细胞膜上的离子通道或转运蛋白提供底物H+,加速细胞质H+向胞外运输;3) 细胞内肌肽还可以通过SLC15A1-4转运体直接将细胞质中H+ 转运到内体/溶酶体以及细胞外。作者还探究了低氧导致肿瘤细胞中肌肽合成增多的原因,发现低氧条件下肿瘤细胞中的肌肽主要是由肌肽合酶2(CARNS2)催化合成的。CARNS2是本项工作新发现的一种肌肽合成酶,主要表达在肝癌细胞或组织中,是由低氧微环境诱发可变剪切生成的。而之前报道的肌肽合酶1(CARNS1)主要表达在正常肌肉及脑组织中。
通过共聚焦等实验,研究人员进一步发现,操纵细胞内CARNS2的蛋白水平或者肌肽的含量,能够改变溶酶体在细胞中的定位,进而影响其酸化和功能。考虑到溶酶体参与了细胞内蛋白质的降解过程,研究人员通过溶酶体蛋白质组学筛选到在低氧条件下受肌肽通路显著调控的关键分子NFX1。NFX1是一个转录抑制因子,有报道其参与调控巨噬细胞的免疫反应,但在肿瘤免疫中发挥怎样的功能目前还未被挖掘。为了探讨胞内pH与肿瘤免疫之间的关联,研究人员通过RNA-Seq等实验进一步分析了NFX1的下游通路,发现NFX1能够显著抑制免疫检查点蛋白Galectin-9的表达。作者在同种移植瘤以及YAP5SA诱导的原位小鼠肝癌模型中,分析CARNS2-NFX1-Galectin-9通路对肿瘤免疫的影响,研究结果显示,敲低CARNS2能够显著上调肿瘤浸润T细胞的数量,并且T细胞耗竭减少,效应功能增强。这些研究结果表明,肿瘤细胞中的肌肽通过维持胞内pH稳态,从而维持溶酶体在细胞内的定位及功能,降解转录抑制因子NFX1,进而促进Galectin-9的表达,最终实现肿瘤细胞的免疫逃逸。临床实验数据也表明CARNS2/NFX1/Galectin-9调节轴的异常激活与肝癌的发生发展高度相关。
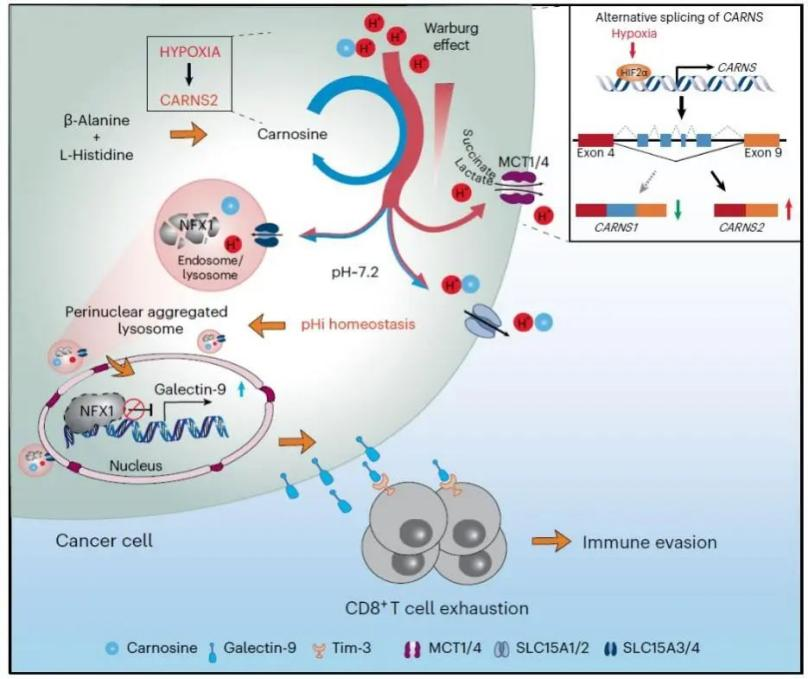
图1. 肌肽通过维持胞内pH稳态及溶酶体活性促进肿瘤免疫逃逸
本研究以“Warburg 效应”产生的大量乳酸为切入点,探讨肿瘤细胞内pH稳态维持的机制,揭示胞内pH稳态、溶酶体功能与免疫逃逸之间的关联,为通过靶向干预胞内pH及溶酶体功能、重塑免疫微环境来改善肿瘤免疫治疗提供了潜在的新思路和新策略。
原文链接:https://www.nature.com/articles/s41590-023-01719-3