
 日期:2021/12/16
日期:2021/12/16 来源:iNature
来源:iNature
接受干扰素 (IFN)-α 治疗的慢性乙型肝炎 (CHB) 患者通常表现出较差的 HBeAg 血清学反应。因此,针对 CHB 的新疗法存在未满足的需求。2021年11月5日,中国工程院院士、大健康研究院院长田志刚,中国科学技术大学魏海明及安徽医科大学李家斌共同通讯在Signal Transduction and Targeted Therapy (IF=18.19)在线发表题为“Restoration of HBV-specific CD8+ T-cell responses by sequential low-dose IL-2 treatment in non-responder patients after IFN-α therapy”的研究论文,该研究包括两项临床试验,包括 130 名未接受过治疗的 CHB 患者;首先,92 名患者在接受 Peg-IFN-α-2b 治疗后进行了体外白细胞介素 2 受体 (IL-2R) 表达和抑制分子表达的系统分析。在第二项临床试验中,38 名 IFN-α 治疗失败的无反应患者接受或不接受低剂量 IL-2 治疗 24 周。然后检查了这些患者的乙型肝炎病毒 (HBV) 特异性 CD8+ T 细胞反应和临床结果。
尽管接受 Peg-IFN-α-2b 治疗的大多数参与者是无反应者,但该研究观察到他们的 CD4+ T 细胞上 CD25 表达下降,这表明 IFN-α 治疗可能为序贯 IL-2 治疗提供了一个基本原理,而无需增加调节性 T 细胞 (Tregs)。在用 IL-2 进行序贯治疗后,该研究证明无反应者的 Treg 数量和程序性细胞死亡蛋白 1 (PD-1) 表达减少。此外,连续 IL-2 给药挽救了有效的免疫功能,涉及STAT1的激活。重要的是,IL-2 治疗显著增加了 HBV 特异性 CD8+ T 细胞的频率和功能,这在无反应的 CHB 患者中转化为改善的临床结果,包括 HBeAg 血清学转换。总之,研究结果表明序贯 IL-2 治疗显示出挽救难治性 CHB 无反应患者免疫功能的功效。
另外,2021年9月15日,大健康研究院院长田志刚,中国科学院深圳先进技术研究院毕嘉成及中国科学技术大学孙昊昱等团队合作在Science Advances 在线发表题为“TIPE2 is a checkpoint of natural killer cell maturation and antitumor immunity”的研究论文,该研究报告 TIPE2 表达在 NK 细胞个体发生过程中逐渐增加,这与它们在小鼠和人类中的成熟阶段相关。NK 特异性 TIPE2 缺陷增加了小鼠成熟 NK 细胞,这些 TIPE2 缺陷 NK 细胞在刺激时表现出增强的活化、细胞毒性和 IFN-γ 产生,并增强了对 IL-15 成熟的反应。此外,TIPE2 抑制了人和鼠 NK 细胞中 IL-15 触发的 mTOR 活性。因此,阻断 mTOR 限制了 TIPE2 缺乏对响应 IL-15 的 NK 细胞成熟的影响。最后,NK 特异性 TIPE2 缺陷小鼠对体内肿瘤生长具有抗性。总之,该研究结果揭示了小鼠和人类 NK 细胞成熟和抗肿瘤免疫的有效检查点,表明了一种有前景的靶向 TIPE2 用于基于 NK 细胞的免疫疗法的方法。
2021年9月17日,大健康研究院院长田志刚与中国科学技术大学彭慧共同通讯在Nature Communications 在线发表题为“METTL3-mediated m6A RNA methylation promotes the anti-tumour immunity of natural killer cells”的研究论文,该研究报告了肿瘤浸润性 NK 细胞中 m6A“写入器”METTL3 的表达降低,以及 METTL3 的蛋白质表达水平与 NK 细胞中的效应分子之间的正相关。 该研究发现NK 细胞中 Mettl3 的缺失会改变 NK 细胞的稳态并抑制 NK 细胞在肿瘤微环境中的浸润和功能,导致肿瘤加速发展并缩短小鼠的存活期。编码 SHP-2 的基因经过 m6A 修饰,在 METTL3 缺陷的 NK 细胞中其蛋白表达降低。SHP-2 活性降低使 NK 细胞对 IL-15 反应迟钝,这与 METTL3 缺陷 NK 细胞中 AKT 和 MAPK 信号通路的抑制激活有关。这些发现表明m6A甲基化保护了 NK 细胞的稳态和肿瘤免疫监视功能。
2021年9月12日,大健康研究院院长田志刚,中国科学技术大学彭慧及孙汭共同通讯在Hepatology 在线发表题为“Requirement of RORα for Maintenance and Anti-Tumor Immunity of Liver-Resident Natural Killer Cells/ILC1s”的研究论文,该研究发现 RORα 在肝脏驻留 NK (LrNK) 细胞/ILC1s 中高表达。对 LrNK 细胞/ILC1s 和常规 NK (cNK) 细胞中的 Rora 进行条件消融的小鼠 LrNK 细胞/ILC1s 减少,但 cNK 细胞数量正常。RORα 缺陷的 LrNK 细胞/ILC1s 显示出增加的细胞凋亡和显著改变的转录谱。使用结直肠癌肝转移的小鼠模型,该研究发现 RORα 条件性缺陷导致更激进的肝肿瘤进展和 LrNK 细胞/ILC1 中效应分子的表达受损。因此,用 RORα 激动剂治疗有效地限制了肝转移并促进了 LrNK 细胞/ILC1s 的效应分子表达。总之,该研究揭示了 RORα 在 LrNK 细胞/ILC1 维持和功能中以前未定义的作用,为利用 LrNK 细胞/ILC1 活性治疗肝癌提供了见解。
2021年7月6日,大健康研究院院长田志刚,中国科学技术大学魏海明及Sun Zimin共同通讯在Nature Communications 在线发表题为“Inflammatory monocytes promote pre-engraftment syndrome and tocilizumab can therapeutically limit pathology in patients”的研究论文,该研究表明脐带血来源的炎性单核细胞产生的 GM-CSF 驱动 PES 病理,并且单核细胞是 PES 期间 IL-6 的主要来源。此外,该研究报告了托珠单抗(tocilizumab)治疗类固醇难治性重度 PES 患者的单臂、单中心临床研究的结果 。该研究符合主要结果指标,因为在 100 天的随访期间没有患者出现非复发性死亡。该研究还满足了中性粒细胞植入和造血的关键次要结果指标。这些发现提供了一种治疗策略,用于解决 PES 和改善非复发死亡率。
2021年3月21日,大健康研究院院长田志刚,中国科学技术大学彭慧、孙汭及法国马赛大学EricVivier 共同通讯在Science 发表题为“Liver type 1 innate lymphoid cells develop locally via an interferon-γ-dependent loop” 的研究论文,该研究发现成年肝脏造血前体细胞向1型天然淋巴细胞(肝脏ILC1,即肝脏定居NK细胞)的分化潜能及调控机制,揭示天然淋巴细胞的骨髓外发育新路径。

尽管第 69 届世界卫生大会批准了到 2030 年消除病毒性肝炎的全球卫生部门战略,但目前来自 120 个国家的大约 2.5 亿患者感染了乙型肝炎病毒(HBV)。2013 年推出了一种针对丙型肝炎病毒 (HCV) 感染的高效治疗方法,但乙型肝炎在某种程度上被其他公共卫生优先事项所掩盖,治愈的可能性仍然难以捉摸。
迄今为止,干扰素 α (IFN-α) 是 HBV 感染的首选治疗方法。IFN-α 被认为通过激活一系列干扰素刺激基因 (ISG) 和降解核病毒 DNA(可能通过外泌体或载脂蛋白 B 编辑复合物 3 (APOBEC3) DNA 编辑酶)。此外,IFN-α 增强细胞毒性CD8+T 细胞的免疫功能,并挽救自然杀伤 (NK) 细胞的细胞毒活性,自然杀伤 (NK) 细胞是先天抗病毒免疫的重要组成部分,可以快速响应病毒感染的细胞。细胞毒性 CD8+ T 细胞反应的质量和程度对于克服慢性病毒感染很重要;然而,最近评估 IFN-α 治疗效果的研究报告了乙型肝炎 e 抗原 (HBeAg) 血清转化率仅 30%,乙型肝炎表面抗原 (HBsAg) 丢失率约为 5%。因此,在持续感染期间,仅靠 CD8+ T 细胞可能不足以清除病毒,而 NK 细胞也可能值得关注。
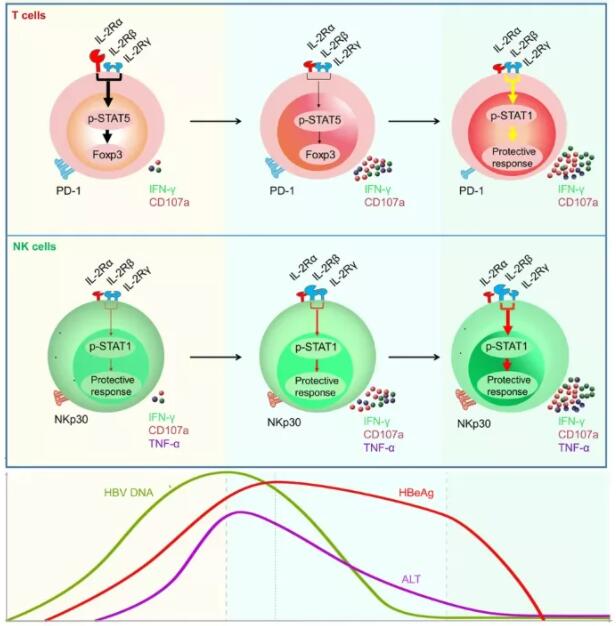
文章模式图(图源自Signal Transduction and Targeted Therapy )
尽管 IFN-α 可以在急性感染期间激活 T 细胞反应,但慢性 IFN-α 暴露可能会导致免疫抑制并对控制病原体的 T 细胞有害。据报道,在持续病毒感染期间,慢性 IFN-I 信号传导可能会驱动免疫抑制程序,并且 IFNR 阻断显著提高了 T 细胞免疫和对 LCMV 感染的控制。此外, IFN-α 治疗人类持续性 HBV 感染可能通过显著上调CD24+CD38hi B细胞的水平来诱导慢性 HBV 患者的免疫调节作用,这可以驱动免疫抑制程序并降低抗病毒作用。然而,这些抑制途径的体外调节仅在少数慢性乙型肝炎 (CHB) 患者中实现了有效的功能恢复。因此,确定有效治疗乙型肝炎的新的、耐受性良好的疗法是至关重要的。
最近的许多研究回顾了白细胞介素 (IL)-2 的多种功能,例如它通过调节 T 细胞和 NK 细胞的抗病毒作用,以及它在治疗肿瘤中的作用。IFN-α 可提高 IL-2 活性,从而在 CHB 中发挥治疗作用。IL-2 和 IFN-α 联合治疗在延长 RCC 患者的生存期方面显示出一定的前景。 然而,IL- 2 静脉内给药时会产生严重的副作用,并且会驱动 Treg 扩张。
CD25 (IL-2Rα) 是 IL-2 受体的“低亲和力”形式 (Kd~ 10?8M)。CD25 介导的STAT5)的磷酸化诱导FOXP3表达,这对于 Treg 的产生是必不可少的。CD122 (IL-2Rβ) 和 CD132 (IL-2Rγ) 亚基的配对导致形成中等亲和力的 IL-2 受体(Kd =10?9M),当它与 IL-2 结合时,会促进细胞溶解活性和 T 细胞的扩增。此外,CD25 与中等亲和力受体的结合导致高亲和力受体(Kd = 10?11M)的形成,在 CD4+ Tregs 上以高水平组成性表达,从而允许它们与其他类型细胞可获得 IL-2。迄今为止,很少有研究证明 IFN-α 可以抑制 CHB 患者外周血单核细胞 (PBMC) 中 Tregs 的产生。
这项研究提供了对连续 IL-2 治疗期间 HBV 特异性CD8+ T 细胞功能的洞察。在此,该研究评估了 NR 患者中免疫抑制分子的表达和 Treg 细胞的百分比,并研究了连续低剂量 IL-2 治疗期间 HBV 特异性CD8+ T 细胞反应。此外,该研究旨在确定这种方法是否可以改善初始 IFN-α 治疗失败的 NR 患者的临床结果。